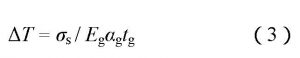Vasiliki等[6]设计了用于检测生物素-抗生蛋白链菌素的超薄Si膜电容式生物传感器。当超薄Si膜表面功能化的探针分子与其对应的目标物发生相互作用时, 超薄Si膜的表面应力生物会导致Si膜产生形变, 从而使器件输出电容改变, 利用biotin–NHS探针可成功检测浓度为2.1×10–8mol/L的抗生蛋白链菌素目标分子。Srinath等[7]提出了parylene (聚对二甲苯) 薄膜表面应力生物传感器并在化学物质测试中对三种不同官能团 (—COOH, —CH3, —OH) 进行了检测。然而, 传感器的灵敏度与应变单元材料的机械硬度有关, 应变单元材料的杨氏模量E越大, 机械硬度越大, 一定表面应力下其形变越小, 灵敏度越低;反之灵敏度越高。因此, 测量小应变时选用聚合物parylene (E=3.2 GPa) 作应变单元优于选用Si (E=169 GPa) 。新型聚合物材料PDMS (polydimethylsiloxane, 聚二甲基硅氧烷) 的杨氏模量E仅为0.007 GPa, 相对上述常用薄膜, 灵敏度更高, 且杨氏模量大小与其加工工艺有着一定的关系, 可通过工艺研究使其探测灵敏度最大化, 利于分析检测;而且成本低, 使用简单, 同硅片之间具有良好的粘附性, 具有良好的化学惰性和生物相容性, 并且无毒, 非常适合作为生物传感应变膜。Sang等[8]设计了利用PDMS微薄膜作传感膜的表面应力生物传感器, 采用白光干涉法来测量薄膜加载待测物前后的形变量, 具有良好的检测灵敏度, 但笨重的光学检测仪器限制了其小型化的应用。
1 原理分析及结构参数设计
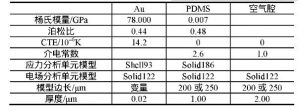
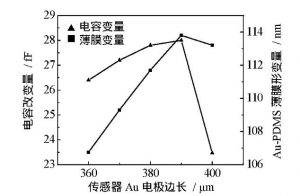
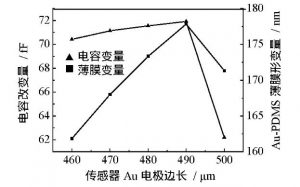
基于PDMS微薄膜的电容式表面应力生物传感器模型如图1所示, 传感单元由上电极Au、PDMS微薄膜、空气腔及底电极组成[10], Au薄层可在醇溶液中形成具有特异性结合的Au—S键固定探针分子, 因此被用于覆盖在PDMS微薄膜上制作电容传感器的上电极;Si具有优良的介电性能, 作为基底材料。当传感器上电极的探针分子与目标物发生生物化学反应时, 分子间作用力将导致薄膜表面应力改变, 使Au-PDMS应变膜发生形变, 引起两电极间距产生变化 (图1中Δd) , 从而使输出电容改变, 进而通过测量电容变化量可检测目标样本的浓度。